Configuración electrónica del Azufre
 La configuración electrónica del azufre es 1s² 2s² 2p⁶ 3s² 3p⁴. El azufre es un elemento químico no metálico de la tabla periódica, el cual se representa por su símbolo S y su número atómico 16. Este se halla creando sulfonales y sulfuros en su forma reducida, y en regiones volcánicas en su forma nativa.
La configuración electrónica del azufre es 1s² 2s² 2p⁶ 3s² 3p⁴. El azufre es un elemento químico no metálico de la tabla periódica, el cual se representa por su símbolo S y su número atómico 16. Este se halla creando sulfonales y sulfuros en su forma reducida, y en regiones volcánicas en su forma nativa.
Tiene un aspecto amorronado, amarillento fuerte o anaranjado y suele arder produciendo una llama de color azul, lo cual indica el desprendimiento de dióxido de azufre. Este no puede disolverse en agua pero sí en benceno y en disulfuro de carbono.
Isótopos del Azufre
 El azufre posee en total 25 isótopos donde solo 4 son estables, estos son: 32S, 33S, 34S, y el 36S. Por otro lado, el isótopo 35S se crea cuando incide en el argón 40 la radiación cósmica, presentado así un periodo de semidesintegración de 87 días, los isótopos radiactivos que quedan son de vida corta.
El azufre posee en total 25 isótopos donde solo 4 son estables, estos son: 32S, 33S, 34S, y el 36S. Por otro lado, el isótopo 35S se crea cuando incide en el argón 40 la radiación cósmica, presentado así un periodo de semidesintegración de 87 días, los isótopos radiactivos que quedan son de vida corta.
Configuración electrónica del Azufre
El número de electrones que posee el átomo de azufre siempre será el mismo número de protones, o sea siempre será 16.
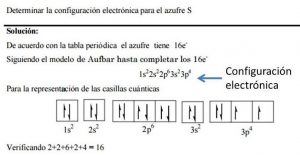
Para conocer el conjunto de números cuánticos del electrón final del átomo de azufre se realiza el diagrama diagonal hasta cubrir los 16 electrones, donde se obtiene la siguiente configuración electrónica:
S= 1s2 2s2 2p6 3s2 3p4
En este caso, los dos primeros números se consiguen siguiendo la configuración 3p4, donde n corresponderá al número que se ubica antes del subnivel s, p, d, f. En este caso n es igual a 3.
El valor dependerá directamente del subnivel, si: s=0, p=a, d=2, f=3. En este caso l=1. Para hallar los dos números cuánticos restantes se realiza el procedimiento donde los valores magnéticos dependerán directamente del subnivel, siguiendo siempre el diagrama de diagonales.
Configuración electrónica del Azufre simplificada
Para realizar la configuración se ha de tomar en cuenta el gas noble del elemento químico anterior al azufre y las capas finales del átomo.
En este caso: en la configuración del azufre, que es: 1s2 2s2 2p6 3s2 3p4, el gas noble que en la tabla periódica va antes del azufre, que en este caso es el neón, llegará a ser el elemento que se tomará en consideración, el cual se configura de la siguiente forma:
Ne: 1s2 2s2 2p6
Tanto en la configuración electrónica del azufre como del neón sus tres primeros orbitales son los mismos:
S: 1s2 2s2 2p6 3s2 3p4
Ne: 1s22s22p6
En este caso lo que se hace es cambiar los tres orbitales en la configuración electrónica del azufre por el símbolo de este gas noble, o sea, del neón y colocarlo entre corchetes, dejando así los dos orbitales restantes que el azufre posee.
Ejemplo:
S: [Ne] 3s2 3p4
Por tanto siguiendo la configuración simplificada del azufre se representará de la siguiente forma:
S: [Ne] 3s2 3p4.
Propiedades del Azufre
- Su número atómico es 16 y se representa a través del símbolo S.
- Pertenece al grupo 16 y al periodo 3 de la tabla periódica.
- Tienen un estado de oxidación de -2, lo cual corresponde a la suma de las cargas negativas y positivas de un átomo, lo cual dará a conocer de una forma indirecta la cantidad de electrones que ha cedido o aceptado el átomo, o sea, se consigue una aproximación de procesos de reducción y de oxidación.
- Su masa se determina a través de la masa total de los protones y electrones. Su masa atómica es de 32,065 u.
- Posee un punto de ebullición de 717,87 grados K y de fusión de 388,36 grados Kelvin.
- Se presenta como un elemento sólido, cristalino y con un tono amarillo brillante.
- Es muy malo como conductor de la electricidad y del calor.
- Forma parte del grupo no metálico de la tabla periódica.
- En su forma natural presenta un estado sólido.
- No posee lustre.
- Es muy frágil, por tanto no se puede aplanar ni estirar para crear láminas e hilos.

También te puede interesar...