Configuración electrónica del Neodimio
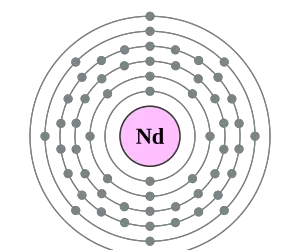 La configuración electrónica del Neodimio es [Xe]4f4 6s2. Se le llama neodimio al elemento químico que forma parte de la tabla periódica, su número atómico es 60 y es representado por el símbolo Nd. Se halla en estado sólido cuando se encuentra en temperatura ambiente, compone al grupo de las tierras raras y se descubrió en 1885.
La configuración electrónica del Neodimio es [Xe]4f4 6s2. Se le llama neodimio al elemento químico que forma parte de la tabla periódica, su número atómico es 60 y es representado por el símbolo Nd. Se halla en estado sólido cuando se encuentra en temperatura ambiente, compone al grupo de las tierras raras y se descubrió en 1885.
Esta tierra rara forma parte del metal de Misch el cual tiene una proporción aproximada de 18%, convirtiéndola en una de las tierras raras con mayor reactividad.
Tiene un brillo metálico de tonalidad plateada y brillante. Puede oscurecer de forma rápida cuando hace contacto con el aire al crear un óxido. Es parte de la familia de los llamados elementos de transición interna y en su forma estable contiene 60 electrones. Su isótopo más popular es Nd-142.
Configuración Electrónica del Neodimio
 La configuración electrónica de un elemento permite conocer la manera en la que se estructuran los electrones que son encontrados en los átomos de dicho elemento.
La configuración electrónica de un elemento permite conocer la manera en la que se estructuran los electrones que son encontrados en los átomos de dicho elemento.
El neodimio tiene una configuración electrónica completa que se escribe como 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f4 6s2 y su versión abreviada o simplificada es [Xe]4f4 6s2.
La distribución de estos 60 electrones que componen al neodimio se hace de la siguiente forma: la primera capa se compone de 2 electrones, la segunda posee 8 electrones, en la tercera capa se encuentran 18 electrones, en la cuarta existen 22, la quinta alberga 8 electrones y la sexta sólo tiene 2.
Este elemento se ubica en el periodo 6 de la tabla periódica. La masa atómica del mismo es de 144,24 u. La masa atómica se determina gracias a la masa total de los protones y neutrones que son hallados en un único átomo que forme parte del elemento.
El radio de Bohr o radio atómico del neodimio es de 206 pm y su radio medio es igual a 185 pm. El punto de ebullición del neodimio es de 3100,85 grados centígrados o grados Celsius, lo cual es igual a 3373 grados Kelvin. El punto de fusión de este elemento es de 1024,85 grados centígrados o grados Celsius, similar a 1297 grados Kelvin.
Isótopos del Neodimio
El neodimio natural se compone de 5 isótopos estables, estos son: Nd143, Nd142, Nd146, Nd145 y Nd148. El de mayor abundancia es el Nd142 teniendo un 27.2%. También existen dos radioisótopos los cuales son Nd150 y Nd144.
Hay un total de 31 radioisótopos caracterizados del neodimio, el de mayor estabilidad es el Nd150 cuyo período de semidesintegración es mayor a 1.1×1,019 años. Después está el Nd144 que tiene 2.29×1,015 años y por último el Nd147 que posee 10.98 días. Los otros isótopos radiactivos poseen periodos de semidesintegración inferiores a los 3.38 días, casi todos por debajo de los 71 segundos.
El neodimio tiene cuatro estados metaestables, los de mayor estabilidad son: el Ndm135 que tiene 5.5 minutos, el Ndm139 de 5.5 horas y el Ndm141 de 62 segundos.
El principal modo de desintegración al isótopo estable de mayor abundancia, el cual es Nd142, corresponde a la captura electrónica y el modo principal después de éste es gracias a la emisión beta. El producto de desintegración principal de este isótopo estable es el praseodimio y el producto principal que le sigue es el prometio.
Peligros del Neodimio
- El neodimio forma parte de los elementos químicos raros que puede ser hallado en residencias, principalmente en aparatos como auriculares de casco, televisores a color, cristales y lámparas fluorescentes. Cada uno de los compuestos químicos raros poseen propiedades comparables.
- El metal en polvo de este elemento puede ser peligroso al explotar o en la combustión.
- El neodimio representa mayor peligro en el lugar de trabajo porque los gases y las humedades pueden ser inhaladas en el aire, lo cual puede llegar a producir embolia pulmonar, mayormente cuando existen exposiciones de mucho tiempo. Si el neodimio es acumulado en el organismo humano, puede amenazar al hígado.
- Este elemento rara vez es hallado en la naturaleza porque se da en cantidades demasiado pequeñas, usualmente se haya únicamente en dos clases diferentes de minerales. Las aplicaciones del neodimio siguen en aumento porque es de utilidad para pulir cristales y crear catalizadores.
- Produce daños en la membrana celular de los animales acuáticos, principalmente afectando el funcionamiento del sistema nervioso y la reproducción.
- El neodimio se vierte en el medio ambiente en distintos lugares, básicamente por las industrias que producen petróleo. También puede ingresar a la naturaleza cuando se desechan los equipos domésticos. De esta manera se acumula de forma gradual en las aguas subterráneas y en los suelos trayendo como consecuencia el incremento en la concentración de animales, humanos y partículas del suelo.

También te puede interesar...