¿Qué es un átomo?
 Todo lo que nos rodea está formado por átomos. El aire que respiramos, la tierra en que habitamos e incluso nuestro cuerpo están formados por ello. Es un término proveniente del latín atŏmus y del griego átomon, donde a significa sin y tomos: sección, que literalmente se interpreta como: que no se puede cortar, que es indivisible.
Todo lo que nos rodea está formado por átomos. El aire que respiramos, la tierra en que habitamos e incluso nuestro cuerpo están formados por ello. Es un término proveniente del latín atŏmus y del griego átomon, donde a significa sin y tomos: sección, que literalmente se interpreta como: que no se puede cortar, que es indivisible.
El término fue propuesto por los filósofos griegos Demócrito y Leucipo. Durante el siglo v a.C Leucipo sostenía que existía un solo tipo de materia y que si esta se cortaba en trozos cada vez más pequeños llegaría un momento en el que no se podría cortar más, a lo que Demócrito llamó átomos, ya que no tenían división.
El átomo
Definición de átomo
De un modo más formal, el átomo puede ser definido como la estructura en la que se organiza la materia y la unidad constituyente más pequeña de la misma.
El concepto de átomo data desde la antigüedad, en específico desde el siglo V antes de Cristo. Fueron los griegos Demócrito y Leucipo quienes le adjudicaron este nombre a las partículas indivisibles y de menor tamaño que al combinarse crea la materia.
La estructura en donde se organiza toda la materia se denomina átomo. Es la partícula más pequeña y estable en que puede ser dividido un elemento sin que llegue a perder sus propiedades químicas.
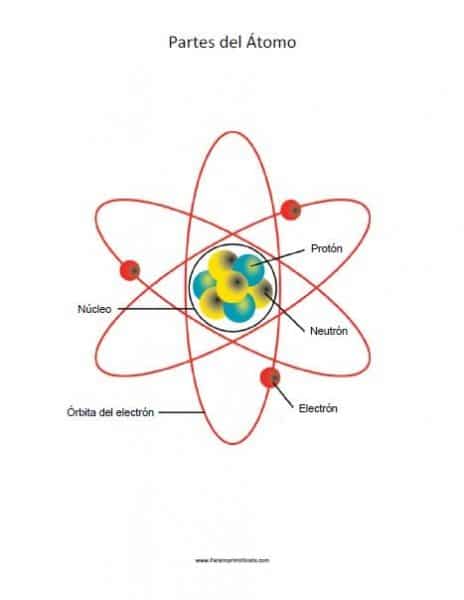
Los átomos forman moléculas cuando se agrupan, y a su vez están constituidos por partículas más pequeñas llamadas partículas subatómicas las cuales se distribuyen en dos partes del átomo, donde se encuentran los electrones, protones y neutrones, teniendo en cuenta que los electrones son las partículas subatómicas con cargas negativa, los protones son lo que poseen carga positiva, y los neutrones no poseen carga.
Tamaño del átomo
 Los tamaños regulares de un átomo van alrededor de 10 pm, es decir, la diez mil millonésima parte de un metro. Hasta el momento, los átomos no presentan límites bien definidos en cuanto a su tamaño por lo que hay diferentes formas para definir su tamaño.
Los tamaños regulares de un átomo van alrededor de 10 pm, es decir, la diez mil millonésima parte de un metro. Hasta el momento, los átomos no presentan límites bien definidos en cuanto a su tamaño por lo que hay diferentes formas para definir su tamaño.
Partes de un átomo
Los átomos se pueden dividir en dos partes, estas son: el núcleo y la corteza, los cuales a su vez presentan subdivisiones.
Núcleo de un átomo
Se estima que alrededor de 99,94% de la masa que posee un átomo se encuentra en el núcleo. Es la parte central del átomo, considerado como su corazón. Está constituido por neutrones y protones, los cuales se les nombre como nucleones, los primeros poseen carga neutra y pesan lo mismo que los electrones, o sea que no tienen carga, y los protones poseen carga positiva y pesan 1.836 veces más que los electrones.
Tanto los neutrones como los protones se mantienen unidos gracias a la energía nuclear, por ello siempre el núcleo tendrá carga positiva en la cual se concentra la mayor masa, que es igual a la carga negativa de los electrones dando como resultado una carga eléctrica neutra en todo el átomo. Cuando el número de protones de un átomo difiere con el número de neutrones se le conoce como isótopos.
Está formado por:
Protones
Poseen carga eléctrica positiva.
Neutrones
No presentan carga eléctrica neta. Sin embargo, están presentes en el núcleo atómico de todos los átomos exceptuando el protio (el más común de los isotopos estables de hidrógeno).
La corteza
También denominada nube de electrones o nube atómica, es la región que rodea el núcleo atómico y en la que orbitan los electrones. También se le conoce como nube electrónica ya que en esta parte del átomo es donde orbitan los electrones formando una nube. Conformada solo por partículas con carga negativa. Los electrones llegan a ser las partículas más ligeras del átomo.
Electrones
Son aquellos que poseen carga eléctrica negativa y los cuales a través de la interacción electromagnética se unen al núcleo del átomo.
Propiedades nucleares del átomo
- Se ha observado que durante las reacciones químicas los átomos se mantienen como tales, es decir, no se crean ni se destruyen, pero si crean enlaces diferentes entre un átomo y otro al organizarse de forma diferente.
- Los átomos se agrupan y forman moléculas al hacerlo. La combinación entre un número diverso de átomos que se enlazan entre sí de manera específica dan lugar a un tipo de molécula.
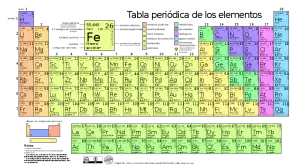
- Los elementos químicos están diferenciados por la composición de cada átomo, definidos por el número atómico y el número másico de cada elemento, los cuales a su vez, podemos encontrar representados en la tabla de los elementos.
- No se destruyen ni se crean durante las reacciones químicas, pero si pueden crear diferentes enlaces entre átomos.
- Su composición permite diferenciar los elementos químicos dentro de la tabla periódica, donde cada elemento presenta un número másico y un número átomo que lo identifica. El número másico representado con la letra A, es el resultado de la suma de los neutrones y los protones que posee un elemento, y el número atómico, representado por la letra Z, es la cantidad total de protones que posee un átomo, lo cual es la misma que los electrones.
- Posee propiedades químicas que pueden ser clasificadas acorde a su número de valencia, su peso y demás características físicas.
- Se distinguen entre sí por la configuración de sus partículas, ahora bien, los átomos que forman parte de un mismo elementos son idénticos.
Número atómico
Indica la cantidad de protones presente en cada átomo; hay que tener en cuenta que el número de protones siempre será igual al número de electrones. El número atómico de un átomo se halla representado por la letra Z.
Número másico
Es aquel que hace referencia a la suma de los protones y neutrones presentes en un elemento y en la tabla periódica queda representado por la letra A.
Tipos de átomos
 Como ya saben los átomos están formados por neutrones, protones y neutrones siendo a su vez la unidad estructural más pequeña de la materia.
Como ya saben los átomos están formados por neutrones, protones y neutrones siendo a su vez la unidad estructural más pequeña de la materia.
El tipo de átomo que encontremos, va estar definido por el número de protones que este posea; hasta el momento podemos ver 118 tipos diferentes de átomos (encontrados en la tabla periódica) que van desde el hidrógeno hasta el oganesón.
Se podría decir que hay tantos átomos, como el número de protones en su núcleo. Por ejemplo, a todos los átomos con un protón en su núcleo se le suele llamar átomo de hidrógeno, a diferencia, de los átomos con un total de 29 protones que se le denomina átomo de cobre.
Átomos naturales
Aquellos que encontramos en la naturaleza e forma normal. Entre estos encontramos 98 elementos de los cuales, el oro, la plata, el cobre y los gases nobles se encuentran de forma pura, es decir son 100% naturales, mientras que otros elementos, como los metales alcalinos (elementos del grupo 1, exceptuando el hidrógeno) y los elementos del grupo, denominados alcalinotérreos, se encuentran combinados con átomos de otros elementos llegando a formar compuestos químicos.
Átomos artificiales o sintéticos
Son aquellos elementos no dados de forma natural porque se crean mediante procesos complejos, ya sea, mediante la fusión nuclear o la utilización de equipos para la aceleración de partículas. Estos elementos, suelen ser radioactivos muy inestables razón por la que su producción es escasa y bastante costosa.
Este tipo de átomos son encontrados en la tabla periódica los cuales encontramos:
- Neptunio
- Plutonio
- Americio
- Curio
- Berkelio
- Californio
- Einstenio
- Fermio
- Mendelevio
- Nobelio
- Laurencio
- Dubnio
- Seaborgio
- Bohrio
- Hassio
- Meitnerio
- Darmstadtio
- Roentgenio
- Copernicio
- Nihonio
- Flerovio
- Moscovio
- Livermorio
- Oganesón
Características del átomo
- Es la unidad básica de la química.
- Tiene una alta tendencia a la estabilidad.
- Se caracterizan por ser extremadamente livianos, donde la masa aproximada de los electrones es menor de 9,1 x 10-28, y la de los neutrones y protones es de 1,675 x 10-24.
- Cumple con la regla del octeto de Lewis.
- Son indestructibles e inalterable. Cada átomo mantiene sus características estructurales esto se evidencia durante las reacciones químicas, donde nunca se destruyen ni se crean, solo se organizan de forma distinta dando a lugar enlaces entre un átomo y otro.
- Al agruparse forman moléculas y materiales de diferentes tipos con características fisicoquímicas. Las moléculas interactúan para crear gases, sólidos y líquidos.
- Los responsables de toda reactividad química de los átomos son los electrones.
- Es el componente de toda materia, por tanto todo lo que existe de forma física está conformado por átomos.
- Pueden transformarse en iones al momento de perder o ganar electrones.
- Varios átomos enlazados entre si forman moléculas.
- Está compuesto por tres subestructuras: los electrones, los protones y los neutrones. Los neutrones y los protones constituyen el núcleo del átomo mientras que los electrones se mantienen orbitando alrededor de este núcleo.
- La mayor masa del átomo se encuentra en el núcleo.
- En un elemento todos sus átomos son iguales.

También te puede interesar...