
La diferencia básica respecto del enlace iónico es que este implica una transferencia de electrones entre dos átomos, mientras que en el enlace covalente los electrones son compartidos entre átomos.
La mayoría de los compuestos formados por enlaces covalentes son poco solubles en agua. Así mismo, cuando se disuelven en agua en ciertas condiciones no forman iones, por tanto, tampoco conducen la electricidad.
En los compuestos covalentes la solubilidad, dependerá de la polaridad molecular, vale decir, del tipo de disolventes en los cuales sean solubles la sustancias. Los compuestos covalentes polares son solubles en disolventes polares como el agua, etanol, etc., y los compuestos covalentes apolares serán solubles en disolventes apolares o de tipo orgánico.
Las características del enlace covalente
Los enlaces covalentes se encuentran en los elementos que son no metálicos
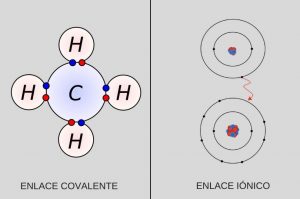
Los enlaces covalentes pueden ser simples, dobles y triples
Las tres formas conocidas de enlace covalente incluyen los enlaces simples, dobles o triples donde 2, 4 o 6 electrones se comparten, respectivamente. Eso depende de la cantidad de pares de electrones compartidos entre los átomos.
Y dicha cantidad de enlaces simples, dobles o triples que un átomo podrá formar dependen directamente de su valencia, o la cantidad de electrones que pueda compartir en su última capa electrónica (orbitales de valencia).
En este marco, cada par de ellos puede ser representado normalmente por una, dos o tres rayitas entre los símbolos de cada átomo. Por ejemplo:
- Molécula de hidrógeno: H – H, la molécula de H2 mediante un enlace simple.
- Molécula de oxígeno: O = O, la molécula de O2 mediante un enlace doble.
- Molécula de nitrógeno: N Ξ N, la molécula de N2 mediante un enlace triple.
Los enlaces covalentes pueden ser de dos tipos
Los enlaces covalentes forman dos tipos de sustancias:
- Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen ciertas propiedades, entre las que podemos mencionar las temperaturas de fusión y ebullición bajas.
- En condiciones normales de temperatura y presión además pueden ser sólidos, líquidos o gaseosos Son blandos en estado sólido, son aislantes de corriente eléctrica y calor.
- Con referencia a las moléculas polares, esta son solubles cuando están en disolventes polares y las moléculas apolares vendrían a ser solubles cuanto están en disolventes apolares.
- Redes: Las sustancias covalentes forman redes, similares a los compuestos de enlaces iónicos, que tienen propiedades de elevadas temperaturas de fusión y ebullición. Son sólidos, aislantes e insolubles.
La Regla del Octeto es aplicable a los enlaces covalentes
Con referencia a los enlaces covalentes, a estos se les aplica la «regla del octeto», la misma que permite determinar cuántos electrones son compartidos para alcanzar el estado de equilibrio.
Recordemos que la Regla del octeto es un enunciado que plantea que los átomos tienden a ganar, perder o compartir electrones para alcanzar los 8 electrones en la capa de valencia.
Los compuestos formados por enlaces covalentes son más abundantes
En este tipo de compuestos, son mucho más abundantes que los iónicos y pueden ser sólidos, líquidos o gaseosos. Hay muchos ejemplos de compuestos o sustancias que contienen enlaces covalentes, entre ellos tenemos:
- Cloro
- Oxígeno
- Agua
- Dióxido de carbono
- Nitrógeno
- Flúor
- Bromo
- Yodo
- Amoníaco
- Metano
- Propano
- Sílice
- Diamante
- Grafito
- Cuarzo
- Glucosa
- Parafina
- Diesel
- Helio
- Freón
- Etc.

