Características del enlace iónico
 El enlace iónico -también conocido como enlace electrovalente- es un tipo de unión química en el que existe una atracción electrostática entre iones con carga opuesta.
El enlace iónico -también conocido como enlace electrovalente- es un tipo de unión química en el que existe una atracción electrostática entre iones con carga opuesta.
Un ion que se encuentra cargado positivamente, va a formar un enlace con un ion cargado negativamente y se produce una transferencia de electrones desde un átomo a otro.
En este tipo de enlace químico, se da cuando los electrones de un átomo pasan a otro. Normalmente se da entre metales y no metales con distinta electronegatividad. El átomo que pierde los electrones se carga positivamente (catión) y el que gana electrones se carga negativamente (anión).
Hay que recordar que conceptualmente, un ion es un átomo o grupo de átomos que adquiere carga positiva o carga negativa debido a una transferencia de electrones.
5 Características del enlace iónico
Se produce por la atracción de iones con cargas opuestas.
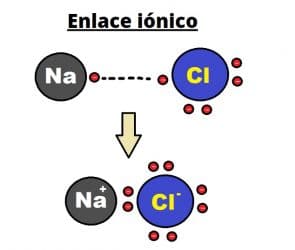 El enlace iónico se establece entre iones con carga positiva llamados cationes e iones con carga negativa llamados aniones.
El enlace iónico se establece entre iones con carga positiva llamados cationes e iones con carga negativa llamados aniones.
Un ejemplo de un compuesto formado por un enlace iónico debido a la atracción electrostática es el cloruro de sodio conocido popularmente como sal de mesa (NaCl).
En ese caso, el elemento que tiene mayor electronegatividad (en este caso Cl) le quitará electrones al otro con menor electronegatividad (Na) y se convertirán en anión (Cl-) y catión (Na+),
Se establece entre átomos con grandes diferencias de electronegatividad
El enlace iónico se establece por lo general entre metales y no metales con diferente electronegatividad. Normalmente, es el metal el que transfiere sus electrones al elemento no metal.
Puntos de fusión y ebullición altos
Los puntos de fusión y ebullición de los compuestos iónicos son especialmente altos debido a sus fuertes interacciones electrostáticas.
Pueden ser solubles o insolubles en agua
Los compuestos iónicos se forman preferentemente cuando metales de los grupos I A y II A se unen con los no metales de los grupos VI A y VII A, establecen redes cristalinas constituidas por N iones de carga opuesta que están unidos por fuerzas electrostáticas.
Si la atracción electrostática es fuerte, se forman sólidos cristalinos de alto punto de fusión e insolubles en agua; si la atracción es menor, como en el caso del cloruro de sodio NaCl, el punto de fusión también es menor y, en general, son solubles en agua e insolubles en líquidos apolares, como el C6H6 (benceno) o el CS2 (disulfuro de carbono).
En estado sólido no conducen electricidad
En estado sólido no conducen corriente eléctrica, ya que los iones ocupan posiciones muy fijas en la red. Si se utiliza cloruro de sodio (un bloque de sal) como parte de un circuito en lugar del cable, el circuito no funcionará. Igualmente tampoco funcionará una bombilla si se utiliza como parte de un circuito un cubo de agua.
En cambio, si se disuelve sal en abundancia en dicho cubo, la bombilla del circuito si encenderá. Esto último se produce debido a que los iones disueltos de la sal o NaCl son capaces de acudir al polo opuesto de la pila del circuito y, por ello, este funciona

También te puede interesar...