 Dentro de la química existen muchas teorías que respaldan los diferentes experimentos y ejercicios necesarios para un correcto estudio de la materia. Aquí te explicaremos información importante sobre la teoría del enlace de valencia.
Dentro de la química existen muchas teorías que respaldan los diferentes experimentos y ejercicios necesarios para un correcto estudio de la materia. Aquí te explicaremos información importante sobre la teoría del enlace de valencia.
Esta teoría se estudia de manera muy superficial en el colegio, y de manera más profundo cuando se estudia alguna carrera relacionada con química, ya que es una información base. Por otro lado, el manejo del tema cuenta con algunas gráficas, que pueden cambiar dependiendo del tipo de ejercicio o del valor que tengas en ese momento. Es por eso debes estar muy atento/a de estos cambios.
La Teoría del enlace de valencia , explica la naturaleza de un enlace químico en una molécula, en términos de las valencias atómicas. La teoría del enlace de valencia se resume en la regla de que el átomo central en una molécula tiende a formar pares de electrones, en concordancia con restricciones geométricas, según está definido por la regla del octeto. La teoría del enlace de valencia está cercanamente relacionada con la teoría de los orbitales moleculares.
Teoría del enlace de valencia
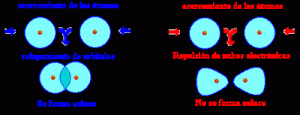 Esta hipótesis explica como dos átomos se enlazan entre sí. También se puede observar la combinación de dos orbitales, considerados atómicos de dos átomos diferentes.
Esta hipótesis explica como dos átomos se enlazan entre sí. También se puede observar la combinación de dos orbitales, considerados atómicos de dos átomos diferentes.
La Teoría del enlace de valencia busca poder explicar y estudiar cómo se da el enlace covalente. En la actualidad se pueden observar una gran cantidad de teorías que explican como se conoce un enlace covalente.
Fue desarrollada por Heitler y London en 1927, aunque posteriormente Slater y Pauling la modificaron para que pudiera justificar más satisfactoriamente la disposición espacial y la energía de los enlaces. El nombre de la teoría hace referencia a que sólo los electrones de valencia son tenidos en cuenta para analizar la formación de enlaces.
Cuando dos átomos se aproximan puede ocurrir que se produzca un solapamiento o interpenetración de las nubes electrónicas de ambos átomos lo que daría lugar a un enlace covalente.
Es importante que conozcas las formas que deben tener las diferentes gráficas, ya que suelen variar. Puedes buscar muchos ejemplos de este tema en este mismo portal sobre química.
También hay ciertos ejercicios que puedes observar en Youtube, para que tengas una idea de la resolución que tendrían. Muchas veces piden solo el proceso del ejercicio y otras veces las gráficas. Es muy importante que mantengas buen dominio de ambos procesos para que de esta manera tengas un aprendizaje completo del tema.
Enlaces de valencia
Enlace simple
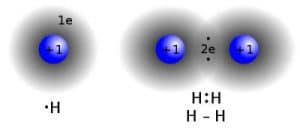 Es la manera más fácil en que el carbono puede compartir sus electrone. Cuando se habla de un enlace simple es solamente un pequeña raya.
Es la manera más fácil en que el carbono puede compartir sus electrone. Cuando se habla de un enlace simple es solamente un pequeña raya.
Enlace doble
- Consiste en la unión entre un enlace P y un enlace S.
- Para representar este enlace se debe colocar solamente dos rayas pequeñas.
Enlace triple
- Este enlace es la unión entre dos enlaces P más un enlace S. Es representado por tres rayas.
- Puedes encontrar muchos ejemplos de estos enlaces en diferentes ejercicios donde los utilizan consultando buenos videos de Youtube.

