¿Qué es la tabla periódica de electronegatividad?
 En la tabla periódica podemos encontrar los diferentes elementos en forma ordenada y distribuidos en 18 grupos y 4 bloques. Esta tabla se encuentra ordenada según el número creciente de los átomos de cada elemento y entre las tendencias que presentan los elementos a ciertas propiedades atómicas encontramos la electronegatividad.
En la tabla periódica podemos encontrar los diferentes elementos en forma ordenada y distribuidos en 18 grupos y 4 bloques. Esta tabla se encuentra ordenada según el número creciente de los átomos de cada elemento y entre las tendencias que presentan los elementos a ciertas propiedades atómicas encontramos la electronegatividad.
La tabla periódica de electronegatividad
¿Qué es la electronegatividad?
 La electronegatividad se define como el poder que tiene el átomo de una molécula para atraer los electrones hacia sí.
La electronegatividad se define como el poder que tiene el átomo de una molécula para atraer los electrones hacia sí.- Una idea muy relacionada al concepto es la afinidad electrónica, de hecho, si algo tiene una electronegatividad alta tendrá una alta afinidad electrónica.
- ¿A qué me refiero con afinidad? A cuanto ese átomo atrae electrones, que tantos quieren o que tantos necesitan.
¿Cuál es la diferencia entre afinidad electrónica y la electronegatividad?
La electronegatividad es un tanto más específica que la afinidad (por supuesto me estoy refiriendo a ella de manera personificada). Cuando un átomo es parte de un enlace covalente, está compartiendo electrones con otro átomo, que tanto quiere quedarse esos electrones. La electronegatividad se define como la capacidad de un átomo para atraer hacia sí mismo los electrones que comparte.
No deben confundirse estos conceptos puesto que la afinidad electrónica mide la energía liberada cuando un átomo gana un electrón y la electronegatividad una medida relativa de la capacidad de atracción.
Cuando se da una interacción entre dos átomos de elementos diferentes siempre habrá uno más electronegativo que otro ejerciendo mayor atracción sobre los electrones de valencia. El tipo de enlace químico y la intensidad que se da entre dos átomos está dado por la diferencia de electronegatividad.
Escalas de electronegatividad
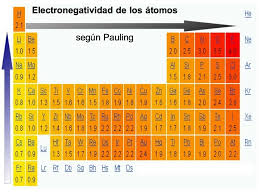
Los distintos valores de electronegatividad son clasificados mediante diferentes escalas, encontrando entre ellas la escala de Pauling y la escala de Milliken.
¿Qué tipos de enlaces se forman según la diferencia de electronegatividad de los átomos?
- Se forman enlaces covalentes no polares si la diferencia de electronegatividad es menor a 0.4.
- Si la diferencia se sitúa entre los 0.4 y 1.7 se forman los enlaces covalentes polares.
- Los enlaces iónicos se dan si es mayor a 1.7.
Escala de Pauling
El químico Estadounidense Linus Pauling fue el desarrollador y creador del concepto de electronegatividad; también estableció las diferencias en los valores electronegativos de acuerdo a sus porciones covalente –iónico. Proponiendo que una diferencia electronegativa de 1.7 le daba un 50-50 de ser iónico o covalente.
En 1954 obtuvo un premio Nobel por sus trabajos acerca del enlace químico.
Aunque existen otras escalas:
- La escala de Sanderson
- La escala de Allred-Rochow.
- La escala de Allen.
La escala de Pauling sigue siendo la más utilizada.
En su escala, Pauling clasificó la electronegatividad de los átomos. Asignando valores según su electronegatividad, por ejemplo, el elemento más electronegativo que es el flúor tiene un índice de 0.4, mientras que al francio que es el menos electronegativo tiene un índice de 0.7, asignando a los demás átomos valores intermedios.
La escala de Milliken
También conocida como la escala Milliken –Jaffe, es una escala de electronegatividad de los elementos químicos, en la que se promedia la afinidad electrónica (A.E) y los potenciales de ionización de sus electrones de valencia.
¿Cómo se cuales son los elementos más electronegativos de la tabla periódica?
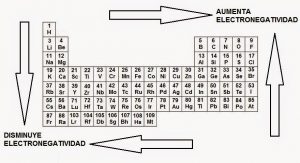 Para esto tenemos una regla básica que nos dice: cuanto más arriba y a la derecha se encuentre un elemento dentro de la tabla periódica más electronegativo será. Siempre teniendo en cuenta que el Flúor es más electronegativo que el Bario.
Para esto tenemos una regla básica que nos dice: cuanto más arriba y a la derecha se encuentre un elemento dentro de la tabla periódica más electronegativo será. Siempre teniendo en cuenta que el Flúor es más electronegativo que el Bario.
Podemos tomar a los metales alcalinos como un ejemplo a esta regla, los cuales presentan una menor electronegatividad en la tabla periódica. Los mayores niveles de electronegatividad lo encontramos en los halógenos.
De todos, el elemento más electronegativo es el flúor (3.98) y el menor el cesio (0.79). En esta regla o más bien patrón general acerca del aumento de la electronegatividad se pueden dar acepciones:
- Los gases nobles: debido a que cuentan con una capa de valencia de electronegatividad completa, tienen una electronegatividad prácticamente nula.
- Por otro lado encontramos a los metales en transición, los cuales presentan una baja variabilidad; su electronegatividad es baja. Tiene mayor facilidad para transformar cationes y ceder electrones.
Ten en cuenta:
- A lo largo de un periodo la electronegatividad aumenta de izquierda a derecha, esto es en su filas.
- En un grupo (columnas de la tabla periódica) la electronegatividad disminuye al moverse hacia abajo.

También te puede interesar...