¿Qué es un isótopo?
 Los isótopos son un conjunto de átomos pertenecientes a un mismo elemento que difieren en número másico debido a que poseen una cantidad diferente de neutrones.
Los isótopos son un conjunto de átomos pertenecientes a un mismo elemento que difieren en número másico debido a que poseen una cantidad diferente de neutrones.
Estos átomos se comportan químicamente de la misma forma y cuenta con igual número atómico. La palabra isótopo proviene del griego isos que significa igual y tópos que se traduce como un mismo sitio; se usan para indicar que los tipos de átomos pertenecientes a un mismo elemento están dispuestos en un mismo lugar en la tabla periódica.
Tipos de isótopos
 Los isótopos pueden ser de dos tipos:
Los isótopos pueden ser de dos tipos:
- Isótopos naturales.
- Isótopos artificiales.
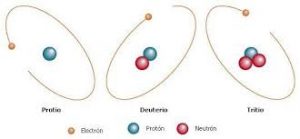
Isótopos naturales
Aquellos que pueden ser encontrados en la naturaleza. El ejemplo más común de isótopos naturales lo encontramos en el hidrógeno, debido a que posee tres isótopos de esta naturaleza:
- El protio.
- Deuterio.
- Tritio.
Isótopos artificiales
Estos isótopos pueden ser producidos por el hombre. Debido a la reactividad que presentan estos isótopos tienen una vida corta. Por ejemplo, los isótopos encontrados en el uranio, más específicamente el uranio 233 es utilizado en la tecnología nuclear.
Los isótopos a su vez se subdividen:
- Isótopos estables.
- Isótopos inestables.
¿Qué es un isótopo estable?
Son los átomos no radiactivos de un determinado elemento con diferencias en su número de electrones y similitudes en el número de protones. Tienen una vida media de 3000 millones de años.
¿Qué son los isótopos inestables?
Son aquellos átomos cuyos núcleos cambian o se desintegran emitiendo radiaciones. La reactividad de los isótopos se debe a la diferencia de electrones y protones que poseen los átomos impidiendo, de esta manera, su estabilidad nuclear; intentando expulsar los protones o neutrones para lograr la estabilidad.
Hay que tener en cuenta que el concepto de estabilidad, en el caso de los isótopos, aún no se encuentra bien definido, debido a la existencia de isótopos casi estables por el tiempo extremadamente largo de neutralización por el que han pasado.
La característica de los isótopos en la que impide el balance entre sus protones y neutrones, es la misma que hace que estos emiten energía de diferentes formas en búsqueda de esa estabilidad, teniendo un periodo de desintegración donde:
- Emiten energía alfa (núcleos de helio).
- Rayos beta (electrones o positrones).
- Gamma (energía electromagnética).
Características de un isótopo
Entre las principales características de los isótopos podemos encontrar:
- Tienen una misma cantidad de protones.
- Poseen las mismas propiedades químicas, un ejemplo de esto es su solubilidad.
- Son átomos pertenecientes a un mismo elemento con diferente número másico y localizados en el mismo lugar de la tabla periódica.
- Pueden ser encontrados en la naturaleza.
- Solo 21 elementos de la tabla periódica cuentan con un único isótopo natural.
- Por su diferencia de masa, pueden presentar diferencias físicas como su densidad.
¿Quién descubrió los isótopos?
El descubrimiento de los isótopos surgió como consecuencia de un estudio sobre las sustancias naturales radioactivas, siendo Frederick Soddy quien en 1911 propuso su nombre: "Isótopos" y recibiendo el premio Nobel de Química en 1921 por sus trabajos acerca de los isótopos y la radioactividad.
Soddy constató la igualdad de sus propiedades químicas y junto a Rutherford notó la causa del comportamiento anómalo de los elementos radioactivos. Llegando a la conclusión de que estos elementos se transformaban en otros y producían radiaciones en forma alfa, beta y gamma.
Importancia de los isótopos
La importancia de los isótopos radica en el uso que a estos se les da:
- Los isótopos pueden ser utilizados como trazadores, me explico, en el ámbito de la medicina son utilizados para demostrar la absorción de un elemento y en la agronomía sirve para el estudio de los fertilizantes.
- También pueden ser utilizados para la radioterapia para destruir células cancerígenas. El cobalto-60 es utilizado en medicina para detener ciertos tipos de cáncer debido a la capacidad que presentan los rayos gammas hacia la destrucción de tejidos cancerosos.
- Los isótopos nos proporcionan números beneficios. Nos ayudan a preservar nuestros alimentos, participa en el tratamiento y diagnóstico de patologías médicas e interviene en los procesos de fotosíntesis.
¿Cómo representar los isótopos de un elemento?
Los isótopos pueden ser representados de dos formas:
Según su notación científica
El nombre del elemento químico será la identificación de los isótopos, seguido por la cantidad de protones y neutrones que posee.
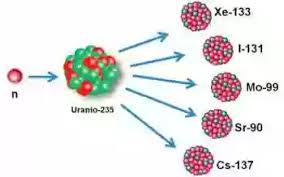 Por ejemplo, el uranio:
Por ejemplo, el uranio:
- U-234
- U-235
- U-238
Mismos que se utilizan como combustible nuclear.
Según su notación simbólica
Es el caso contrario a la notación científica, en esta se coloca el número de protones y neutrones de un elemento como superíndice seguido por el elemento.
Ejemplo:
- 234-U
- 235-U
- 238-U

También te puede interesar...