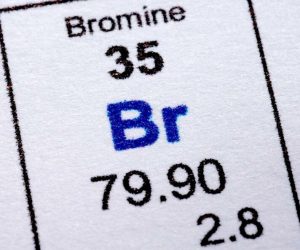
 El bromo es un elemento químico el cual también se le llama fuego líquido desde tiempos antiguos. Se ubica en el grupo de los halógenos de la tabla periódica y su número atómico es 35. Se representa por el símbolo Br.
El bromo es un elemento químico el cual también se le llama fuego líquido desde tiempos antiguos. Se ubica en el grupo de los halógenos de la tabla periódica y su número atómico es 35. Se representa por el símbolo Br.
A temperatura ambiente este elemento es un líquido volátil, rojo y denso. Su reactividad es intermedia entre el yodo y el cloro. Representa un peligro para el tejido de los seres humanos en estado líquido, mientras que sus vapores provocan irritación en la garganta y en los ojos.
El bromo se descubrió en 1826 pero fue en 1860 cuando empezó a elaborarse en importantes cantidades industriales.
Usos del Bromo
 El bromo es un elemento químico muy usado para retardar las llamas porque aísla el oxígeno y permite que el fuego se apague.
El bromo es un elemento químico muy usado para retardar las llamas porque aísla el oxígeno y permite que el fuego se apague.- En el ámbito de la medicina los compuestos de bromuros son utilizados como anticonvulsivos para animales y para humanos. A pesar de esto, su uso puede producir disfunciones neurológicas. El bromo en sus formas bromadas se emplea como componente de analgésicos, sedantes y antialérgicos. Otra función es en el tratamiento de la adicción a la droga de la cocaína y para contrarrestar a la neumonía se emplean los compuestos de bromo como activo principal de los medicamentos.
- En las empresas de bebidas carbonatadas, el bromo se usa para producir aceite que luego se utiliza para la emulsión de estas bebidas.
- El bromo se usa para tratar el agua de las piscinas, para purificar aguas industriales, en los baños termales y para la producción de insecticidas y desinfectantes.
- El bromo etileno se emplea como aditivo en la gasolina porque impide la degradación del motor. Cuando éste se combina con el plomo, el cual también forma parte de la gasolina, produce mucha contaminación, pero actualmente su uso se ha minimizado.
Papel Biológico del Bromo
El bromo es hallado en trazas en el organismo de los seres humanos. Se considera un elemento químico fundamental, aunque no se sabe con exactitud cuales son sus funciones. Algunos de sus compuestos se han utilizado como sedantes y en el tratamiento contra la enfermedad de la epilepsia.
Precauciones con el Bromo
En las sustancias del bromo existe una gran toxicidad causada por un átomo, complejos o iones particulares como el ion cianuro o el ion fluoracetato, junto a otra toxicidad causada por su reactividad.
El flúor y sus compuestos tienen toxicidad, el arsénico también. Mientras que con el bromo su toxicidad es más parecida a la del cloro y es causada por su reactividad, en menor grado que la del cloro. Sus iones negativos bromuro junto al cloruro tienen una toxicidad baja. El cloruro se encuentra en la sangre y en la sal, pero no es tan tóxico. El bromuro tiene mayor toxicidad que el cloruro, pero tampoco posee un nivel alto de riesgo.
Por otro lado, el bromo elemental es sumamente tóxico y sólo con trazas pequeñas que ingresen por inhalación o por la piel, puede producir problemas inmediatos en la salud y tomado en altas dosis, la muerte. Produce gran irritación en la garganta y en los ojos y genera dolorosas quemaduras cuando hace contacto con la piel.
Configuración Electrónica del Bromo
La configuración electrónica de los elementos químicos representa a los electrones y a su ubicación en los subniveles de energía, capa o última órbita. El número atómico del bromo es 35, por lo tanto, su configuración electrónica completa es 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁵.
Para obtener la configuración, esta es leída con una diagonal desde arriba hasta llegar abajo. Esta técnica tiene por nombre principio de construcción o método de lluvia. Se comienza con los subniveles de menor energía hasta sumar todas las cantidades de electrones que el elemento tiene.
En otras palabras, para obtener la configuración electrónica de este elemento se utiliza el diagrama de Moeller y el número atómico del mismo, el cual es 35 en este caso.
El Bromo se puede abreviar la configuración electrónica usando los gases nobles como neón, argón, kriptón y radón. Para esto se procede a seguir los pasos siguientes:
- Se busca el gas noble que se ubica antes del elemento.
- Se realiza un cambio en los subniveles energéticos en los que los exponentes sean la cantidad total del número atómico que pertenece al gas noble por el símbolo del elemento.
El gas noble que se ubica antes del bromo es el argón. El número atómico de este elemento es 18. Por lo tanto, la configuración electrónica abreviada o configuración electrónica de Kernel del bromo es [Ar] 3d¹⁰ 4s² 4p⁵. De esta manera, la configuración electrónica del bromo expresa que tiene 7 electrones de valencia junto a 4 niveles energéticos.

