Se denomina subniveles de energía a la forma en la que los electrones se organizan en las capas electrónicas del átomo; Se toma en cuenta su distribución en el átomo o molécula. A su vez, a estos subniveles se les denomina orbitales.
Subniveles de energia
¿Qué son los orbitales?
- Los orbitales de electrones son definidos como el volumen en torno al espacio y las posibilidades que un electrón tiene para ser encontrado, el cual es de un 95%.
- La mayor probabilidad de encontrar electrones esta en el primer orbital de un átomo y en cada orbital pueden ser ubicados como máximos dos electrones.
- La posición libre e independiente del tiempo de un electrón en la molécula también puede ser representada por los orbitales.
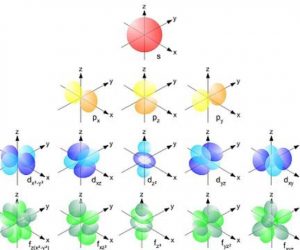
Formas de los orbitales
La forma en la que se organización estos electrones en subniveles es lo que define la posición que ocupan dentro de la tabla periódica y aún más importante lo que, nos permite realizar combinaciones químicas de los átomos.
Existen diferentes tipos de orbitales, con diferentes formas:
Designadas con las letras S, P, D Y F, esto es, Agudo, Principio, Difuso y Fundamental; se unen para formar moléculas más grandes.
Las combinaciones de orbitales son observables en cada capa del átomo:
- Capa 1: Orbitales “S”.
- Capa 2: Orbitales “S y P”.
- Capa 3: Orbitales “S, P y D”.
- Capa 4: Todos los orbitales “S.P, D y F”.
Dentro de la tabla periódica, cada orbital se encuentra representada en forma de bloques específicos.
Orbitales “S”
Cuenta con una simetría esférica alrededor del núcleo del átomo. El bloque de este orbital es la región de los metales alcalinos, donde encontramos: Litio, Rubidio, Potasio, Sodio, Francio y cesio; está formado por el primer grupo de la tabla periódica, incluyendo el Hidrógeno, aunque no es un metal sino un gas.
Este grupo pertenece al de los metales más activos y reactivos, solo poseen un electrón que suele perderse para dar lugar a la formación de un ion con carga positiva.
En el caso del hidrógeno, puede formar iones de una sola carga positiva, sin embargo, bajo presiones altas se vuelve metálico y se comporta como los demás elementos del grupo.
Orbitales “P”
Representa la energía que posee un electrón. Según datos recolectados de Wikipedía su forma geométrica es la de dos esferas achatadas hacia un punto de contacto denominado “núcleo atómico”. Imaginen dos masitas en las cuales su parte plana será el núcleo atómico y la forma que obtenga esa unión será su orientación según los ejes de coordenadas.
Los elementos de este bloque se caracterizan por poseer electrones de valencia. Entre los elementos de este bloque encontramos:
- Boro
- Carbono
- Nitrógeno
- Azufre
- Flúor
- Neón
- Aluminio
- Cloro
- Argón
- Galio, entre otros; Son los situados en los grupos III-A VII-A de la tabla periódica.
Orbitales “D”
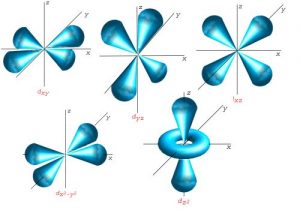
En la tabla periódica, algunos de los elementos pertenecientes a este bloque son:
Orbitales “F”
En sus niveles enérgicos más externos, poseen dos electrones S y en niveles más internos poseen electrones F y en ocasiones, electrones D en los niveles intermedios.
En la tabla periódica, son conocidos como elementos de transición interna o bloque F. Se les llama lantano y actínidos.
Entre los elementos de este bloque podemos encontrar:
- Lantano
- Cerio
- Praseodimio
- Neodimio
- Samario
- Terbio
- Holmio
- Uranio
- Neptuno
- Plutonio
- Curio
- Fermio
- Californio
- Entre otros.
Ubicación del electrón en los orbitales
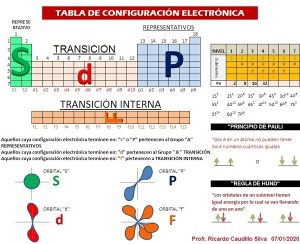
Existen diferentes reglas que determinan la posición de estos electrones, estas son:
- Principio de exclusión de Pauli: establece que un orbital puede describir al menos dos electrones del átomo.
- Principio de Aufbau: Se basa en los diagramas de niveles enérgicos y básicamente, lo que dice es que los electrones ingresan primero a los orbitales con menor energía.
- Regla de Hund: afirma que los electrones ingresan a los orbitales vacíos primeros cuando los electrones ocupan orbitales de la misma energía.

